- Введение
- Факторы
- Показатель pH
- Измерение pH и ошибки
- Разрушение белков
- Исследование влияния на шёлк
- Вещества щелочной природы
- Результаты эксперимента
- Результаты в неводной среде

Внимание! Данная научная статья является независимой и не носит рекламный характер. Все изученные продукты показали высокую эффективность и рекомендуются к использованию.
Введение
Использование щелочных компонентов является важнейшим фактором в стирке наряду с механическим воздействием на материалы. Раньше для повышения уровня щелочности использовали щелок, или водный настой древесной золы, которая благодаря содержащемуся оксиду калия при взаимодействии с водой образовывала гидроксид калия KOH. Для этих же целей выделяли карбонат натрия Na2CO3 из золы некоторых водорослей. В современных профессиональных средствах используются гидроксиды натрия или калия, в порошкообразных – метасиликат натрия, карбонаты или гидрокарбонаты натрия или калия.
Все вышеперечисленные вещества объединяет то, что в воде они распадаются (диссоциируют) с образованием гидроксид-аниона OH–, который является крайне активной химической частицей, определяющей щелочную среду. Она легко вступает в химическое взаимодействие с белковыми и жировыми загрязнениями и приводит к их быстрому распаду.
Однако при этом разрушаются не только загрязнения, но и некоторые материалы белковой природы, такие как шерсть, шёлк, а также вискоза, которая представляет из себя модифицированный ксантогенатными группами полимер целлюлозы. Данный факт приводит к неминуемой порче изделий.
Наша статья будет посвящена анализу уровня щелочности растворов и негативному воздействию веществ, дающих щелочную среду при растворении в воде на белковые волокна.
Факторы
Очень часто полагают, что уровень pH выше 7 гарантирует порчу изделий, опираясь на литературные источники, где указано что шёлк растворяется в течение 5 минут в кипящем растворе 5% щелочи. По нашим данным дело обстоит гораздо сложнее, и порча изделия зависит от следующих фундаментальных факторов:
- Среда. Для диссоциации и образования гидроксид-аниона важно наличие полярной среды, а именно вода или спиртовые растворы. В ином случае он не образуется. Классическими примерами являются такие неполярные растворители как перхлорэтилен, углеводороды KWL, где гидроксиды натрия, калия и другие рассмотренные соединения не растворяются, а значит, и не распадаются на ионы.
- Длительность воздействия и температура. В качестве примера можно привести результаты эксперимента из книги Фёдоровой А.Ф. «Технология химической чистки» (2004 г.) в котором на волокнах шерсти после обработки в перхлорэтилене при температуре 40°С в течении 2 часов образовывались трещины и раковины, а при 80°С начиналось разрушение чешуйчатого слоя. Однако, как мы знаем, при выполнении стандартной химической чистки при комнатной температуре 20-25°С и длительности ванны 5-7 минут разрушения шерсти не наблюдается даже при многократном повторении процесса обработки.
Согласно правилу Вант-Гоффа, температура реакции, в том числе разрушения белковых цепочек, увеличивается в 2-4 раза при повышении температуры на каждые 10°С. Это значит, что те процессы которые происходят в кипящем растворе, при 25°С могут настолько замедлиться, что негативный эффект будет практически не ощутим.
- Концентрации гидроксид-аниона OH–. Значение pH находится в логарифмической зависимости от концентрации данного аниона. Поэтому при уровнях pH в 8 и 12 единиц концентрация будет различаться в 10 000 раз! Следовательно, и скорость деструкции материала будет значительно отличаться. Очень часто повседневное воздействие солнечного света, влаги и механическое повреждение волокон при носке наносит больший вред изделию, чем короткая по времени обработка в слабощелочных условиях.
- Механизм химического разрушения. Это именно тот фактор, про который многие забывают. Любое разрушение материала — это химическая реакция, которая имеет свой механизм. Активная частица (в нашем случае это гидроксид-анион) атакует молекулу материала в определенном месте, вступает в реакцию и происходит распад. Но в химии известно много примеров, когда определенные вещества являются ингибиторами (замедлителями) некоторых процессов. Возможно, и в нашем случае существуют какие-либо защитные механизмы.
Показатель pH
При определении шкалы pH мы сразу допустим важную оговорку для упрощения. В науке вместо концентрации фигурирует так называемая «активность», которая может сильно отличаться в случае большого содержания кислот и щелочей. Поэтому важно помнить, что шкала pH применима только для разбавленных водных растворов. В ином случае вступают в силу иные законы и измерение таких растворов приведет к ошибке.
Кислоты диссоциируют (распадаются) в растворе с образованием катиона H+ (протона), а щёлочи – с образованием аниона OH– (гидроксид-аниона). Дистиллированная вода H2O также диссоциирует, но очень слабо, с образованием и протона и гидроксид-иона. Причём концентрации данных ионов связаны между собой и их произведение постоянно: ионное произведение [H+]х[OH−] при 22ᵒС равно и составляет 10−14 моль2/л2 (0,00000000000001). Таким образом, концентрации протонов [H+] и гидроксид-ионов [OH−] составляют по 10−7 моль/л (0,0000001). Для того, чтобы не оперировать такими низкими значениями ввели упрощенную логарифмическую шкалу и «избавились» от знака минус:
Таким образом, водородный показатель (pH) отражает кислотность или щелочность водных растворов. При температуре 22 °С pH равен 7 для нейтральных, менее 7 для кислых, где преобладают протоны H+, и более 7 для щелочных растворов, где концентрация ионов OH− больше. Водородный показатель служит количественной характеристикой кислотности растворов, которая оказывает существенное влияние на направление и скорость многих химических и биохимических процессов.
Следует также обратить внимание на то, что шкала pH может быть поделена на пять участков, соответствующих (Рис. 1) сильнокислым (0-3), слабокислым (3-7), химически нейтральным (7), слабощелочным (7-11), сильнощелочным (11-14) средам.
Рисунок 1. Пять основных участков шкалы pH.
Высокие концентрации протона или гидроксид-иона могут приводить как к полезным эффектам, таким как разложение жиров щелочью или обесцвечиванию пигментов кислотой, так и наносить вред закреплением красителей на светлых участках кислотой или разрушением белковых волокон щёлочью. Низкие концентрации протона или гидроксид-аниона приводят к меньшим негативным последствиям и даже порой дают определенные преимущества. Поэтому важно понимать, что слабокислая и слабощелочная среды часто являются помощниками в процессах чистки.
Применение показателя pH в химчистке и прачечной
Измерение водородного показателя в индустрии химчисток и прачечных необходимо для:
- Понимания уровня щелочности раствора в прачечной (стирке). Стандартный уровень pH в данном случае колеблется от 10,5 до 13.
- Измерение уровня нейтрализации щелочи на текстиле после последнего полоскания. Допустимый pH от 5,5 до 7. В случае недостаточной нейтрализации возможно раздражение кожи у клиентов при контакте с материалом, а также образование цветных пятен при глажении.
- Измерения уровня pH контактной воды в водоотделителе в химической чистке для понимания качества перхлорэтилена. В случае даже слабокислой среды необходимо проведение мероприятий по нейтрализации образовавшихся в нем кислот.
- Понимания того, что в растворах, содержащих органические растворители, измерение pH любыми методами абсолютно не корректно и его значение не отражает реального состояния таких сред.
Измерение pH и ошибки
Для точных определений pH используют преимущественно методы потенциометрии с измерением электродвижущей силы (ЭДС). При этом важно провести калибровку правильно приготовленными стандартными растворами по двум, а лучше трем точкам. Точное измерение водородного показателя возможно только при условии регулярной калибровки прибора и его поверки.
При определениях, не требующих высокой точности, водородный показатель часто измеряют с помощью ряда индикаторов, каждый из которых меняет свою окраску при определённом значении pH. Чаще всего универсальные тестовые полоски включают по четыре квадрата, обработанных разными индикаторами, что дает возможность сразу получить результат при любом значении водородного показателя раствора от 0 до 14.
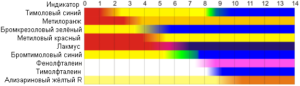
Рисунок 2. Окраска различных индикаторов при различном уровне pH. Пример качественных универсальных полосок для измерения водородного показателя от компании Macherey-Nagel®

Случаи некорректного использования значения pH
Рассмотрим являются случаи некорректного измерения уровня pH в индустрии химчисток и прачечных:
- Измерение уровня pH непрофессиональными, некалиброванными приборами.
- Измерение уровня pH неводных систем, таких как перхлорэтилен, углеводороды и т.п. Полученные результаты будут некорректны! Потенциометрические приборы для измерения pH рассчитаны только для использования в разбавленных водных растворах, а также калибровались по стандартам водных растворов. В неводных средах действуют другие законы, полученные результаты не представляют никакой ценности и не могут быть корректно интерпретированы.
- Измерение уровня pH индикаторными полосками в неводных растворителях, пятновыводителях с большим содержанием растворителей, а также в спиртовых растворах приведут к сходу индикатора с полоски, и поэтому цветовое отображение будет некорректным.
- Ионное произведение для водно-спиртовых, водно-гликолевых и иных комбинаций в концентрированных препаратах для прачечных и химчисток, в том числе пятновыводителей, отлично от 14! Каждая отдельная система может иметь шкалу pH, доходящую до 17, 19 и т.п. Таким образом, адекватное нахождение кислотной и щелочной области возможно только в лаборатории при изучении каждой системы. А значит, применение стандартных методов определения водородного показателя бессмысленно!
- Значение pH 7 отвечает нейтральным водным растворам строго при комнатной температуре. При повышении температуры диссоциация воды усиливается, KBвозрастает, и при 100 °С дистилированная вода имеет pH » При температурах ниже 22 °С в чистой воде нейтральный pH > 7.
Разрушение белковых волокон
Важным процессом в стирке является разрушение белковых загрязнений под действием щелочных компонентов. Строительным «блоком» белков являются аминокислоты (Рис. 3), которые имеют две функциональные группы – аминную и карбоксильную.
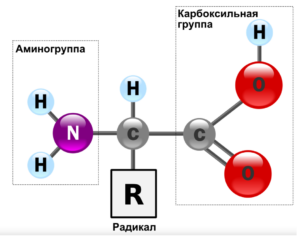
Рисунок 3. Строение аминокислот.
Подобно кубикам известного датского производителя, молекулы аминокислот легко образуют цепочки, соединяющиеся друг с другом посредством реакции одной группы с другой (реакция амидирования). Всего существует 20 различных природных аминокислот с различными радикалами R. Возможно немыслимое количество всевозможных последовательностей. Это и есть первичная структура белков.

Рисунок 4. Четыре уровня организации белковых молекул.
Белки имеют четыре вида организации своей структуры (Рис. 4).
- Первичная структура – длинная молекула (макромолекула), состоящая из последовательности аминокислот. В науке называется полипептидом.
- Вторичная структура – спираль за счёт более слабых водородных связей между группами атомов -NH- и -C=O, расположенных в разных участках макромолекулы, цепочка закручивается.
- Третичная структура – глобула («клубок») образуется при наличии атома серы в некоторых аминокислотах посредством образования дисульфидных мостиков, а также за счёт водородных и ионных связей.
- Четвертичная структура – комплекс из субъединиц. Объединение глобул в более большие агрегаты (встречается не во всех случаях).
Щелочи вступают в реакцию с макромолекулами белка и приводят к их разрушению, а именно «дроблению» на более мелкие части. В итоге, происходит полный распад с образованием натриевых (или калиевых) солей исходных остатков аминокислот (Рис. 5).
![]()
Рисунок 5. Реакция разрушения белков гидроксидом натрия (гидроксид-анионом) по амидной группе, протекает и в случае разрушения шелкового волокна.
Белковые молекулы можно встретить не только среди загрязнений, но и среди материалов. Волокна шерсти и шёлка также образованы белковыми молекулами, которые представляют собой последовательность аминокислот. Например, натуральный шёлк состоит из фиброина, полипептида, синтезированного гусеницей шелкопряда. В кипящем растворе 5-7% гидроксида натрия шёлк разрушается за 9-10 минут. Строение волокон шерсти более сложное, но основным строительным блоком в нём выступает белок кератин.
Таким образом, действие щелочей на натуральные белковые волокна является губительным и приводит к порче. В этой статье мы попробуем проверить данный факт экспериментально.
Исследование влияния различных щелочных компонентов на шёлк
Для исследования мы взяли натуральный 100% шёлк фиолетового цвета плотностью 44 г/м2, который используется для пошива изделий плательной группы.

В начале мы провели базовые исследования по воздействию гидроксида натрия на исследуемый образец:
Эксперимент 1: Полное растворение шёлка в кипящем 5% растворе NaOH. По результатам эксперимента на это потребовалось 10 минут. При этом не обнаружилось волокон другой природы, что говорит о высоком качестве исходного материала, его однородности.
Эксперимент 2: В профессиональной прачечной концентрация NaOH в моющем растворе не превышает 0,3% по массе. Этого достаточно, чтобы решать самые трудные задачи по стирке текстильных изделий. pH раствора при этом составляет 13,2. Образец подвергался воздействию раствора в течение 20 минут при перемешивании магнитным якорем со скоростью 200 об/мин. Данный эксперимент имитирует попадание шёлка в условия высокотемпературной прачечной. Обработанный образец №2 (Рис. 6) сильно истончился и потерял окраску, что свидетельствует о сильной деструкции.
Эксперимент 3: Концентрация NaOH также составляет 0,3% по массе, но температура понижена до 45°С. Полученный образец №3 (Рис. 6), по сравнению с предыдущим, менее разрушен и потерял чуть меньше красителя.
Эксперимент 4: Концентрация NaOH равна 0,3% по массе, температура понижена до 25°С. Полученный образец №4 (Рис. 6), по сравнению с предыдущим, выглядит гораздо лучше и потерял гораздо меньше красителя.
Эксперименты 2 – 4 проводились при равных концентрациях щелочи, уровне pH и в течении одинаковых промежутков времени, но при разной температуре. Легко увидеть, что с уменьшением температуры значительно снижается скорость реакции разрушения материала.
Таблица №1. Разрушение натурального шёлка под действием гидроксида натрия NaOH
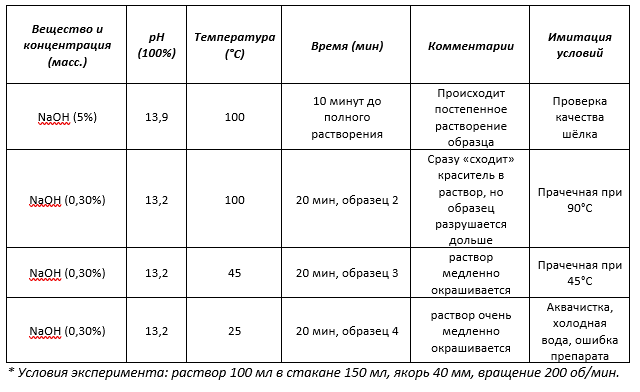


Рисунок 6. Устойчивость окраски шёлка при высоком pH. Слева-направо: 0,3% раствор NaOH при 100°С (2), 0,3% раствор NaOH при 45°С (3), 0,3% раствор NaOH при 25°С (4), образец сравнения при деликатной обработке (5). Снизу приведены соответствующие фотографии с микроскопа Levenhuk 720B.
Далее мы рассмотрим различные вещества щелочной природы, встречающиеся в современных препаратах для химчисток и прачечных.
Вещества щелочной природы, встречающиеся в различных современных продуктах для химчистки, аквачистки и прачечной
В жидких моющих средствах для прачечной, как уже упоминалось, обычно используется гидроксид натрия NaOH. Сильный разрушительный эффект в случае белковых волокон, проиллюстрированный в эксперименте, также характерен для порошкообразных продуктов для стирки, содержащих метасиликат натрия Na2SiO3 и карбонат натрия Na2CO3. Данные вещества, хотя и не содержат в своем составе гидроксил-анион OH–, при попадании в воду, согласно химическим законам, «генерируют» его. Значение pH среда 1% раствора карбоната натрия оказывается 11,76. Кроме того, возможно использование пищевой соды – гидрокарбоната натрия NaHCO3, которая в 1% растворе даёт pH около 9,5 ед.
Наряду с перечисленными, существуют и другие соединения в составе препаратов, которые при попадании в воду дают щелочную реакцию.
1 тип: комплексообразующие соединения (Рис. 7) для связывания ионов жесткости, такие как натриевая соль кислоты ЭДТА (имеющее распространенное торговое названии компании BASF – Трилон Б) или тетранатриевая соль глутаминовой кислоты GLDA-4Na. Первый компонент используется в относительно старых рецептурах, а второй – в тех, где уделено больше внимания биоразложению компонентов. Уровень pH 1% данных соединений составляет около 11 ед. Воздействие данных соединений на шёлк станет предметом дальнейшего исследования.

Рисунок 7. Структурные формулы известных комплексонов: слева Трилон Б, содержащий два атома азота, справа – GLDA-4Na, содержащий один атом азота.
2 тип: в процессе химчистки в хлорорганических растворителях важным аспектом является нейтрализация кислот, которые образуются в перхлорэтилене при эксплуатации машины химической чистки. При отсутствии нейтрализации происходит коррозия оборудования, в том числе, разрушение медного слоя конденсаторов системы дистилляции и сушки с последующим проникновением воды через сварные швы, что влечет негативные последствия. Кроме того, могут происходить процессы закрепления красителей на светлых участках изделий.
Механизм процесса образования соляной кислоты в перхлорэтилене достаточно сложен и не будет обсуждаться в данной статье. Для нейтрализации кислот используется ряд органических аминов. Мы приведем три из них.
Первый: N-метилморфолин. Классический стабилизатор перхлорэтилена для машин химической чистки, который перегоняется совместно с носителем и сохраняет защиту достаточное количество циклов. При этом важно отметить, что pH данного амина (1% раствор) в воде составляет 10,6 ед.! Тем не менее, во всём мире шёлк чистят в присутствии данного соединения без каких-либо проблем. Все дело в том, что перхлорэтилен – соединение неполярное и не вызывает диссоциации соединений, растворенных в нём что приводит к невозможности образования гидроксил-аниона OH–. С другой стороны, даже в неполярной среде амины легко связывают соляную кислоту за счет атома азота.
Часто в паспортах безопасности приводится значение pH 1%-ных водных растворов для усилителей химчистки. Данный параметр приводится только для контроля качества продукции и показывает наличие стабилизаторов для нейтрализации кислот. Любые умозаключения, что в неводной среде такие продукты с pH выше 7 ед. являются высокощелочными и априори портят белковые волокна в корне неверны.
Дополнительное доказательство этого факта приведено ниже.
Второй и третий: распространенные органические амины – моноэтаноламин и диэтаноламин (Рис. 8). Триэтаноламин мы вывели из эксперимента, так как он менее показателен. Данные амины активно связывают кислоты в водных и неводных средах и оказываются очень полезными для стабилизации перхлорэтилена. Уровень pH также достаточно высок – 11,83 и 11,44 ед. соответственно.

Рисунок 7. Амины, встречающиеся в усилителях химической чистки: слева – моноэтаноламин, справа – диэтаноламин.
Действие веществ щелочной природы, а также некоторых усилителей для аквачистки на натуральный шёлк в водной среде
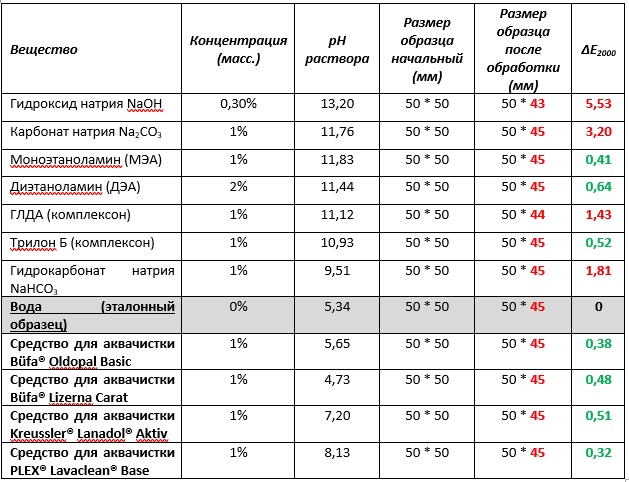
Мы рассмотрели влияние обычных щелочных компонентов, комплексонов и аминов на натуральный шёлк. Для этого было проведено три эксперимента для каждого соединения на куске ткани с точным размером 50 на 50 мм. После экспериментов проводили контроль усадки образцов, а также изменение их цвета профессиональным спектрофотометром 3hn TS8500S в режиме отражения с большой апертурой 25,4 мм (D65/10°) без УФ-фильтра с белой стандартизированной подложкой, что даёт высокую точность измерения интенсивности цвета. Параметром изменения цвета использовалась одна из самых точных математических величин ΔE2000, которая используется повсеместно в отрасли колорантов, крашения тканей, ЛКМ. Значение данного параметра более 1 ед. для тёмных и 0,6-0,7 ед. для светлых тонов соответствует тому изменению интенсивности окраса, которое возможно заметить невооруженным человеческим глазом. Так как была использована ткань фиолетового цвета мы считаем, что при значении ΔE2000<1 можно говорить о сохранении цвета изделия после обработки.
Было проверено действие приведенных выше веществ на натуральный шёлк при 25°С. В результате оказалось, что происходит одинаковая усадка материала практически во всех экспериментах, и в таком тонком («полупрозрачном») материале, как шёлк, нити становятся шире, что приводит к изменению цвета в более тёмную область из-за уменьшения площади отражаемой белой подложки. Поэтому, вместо исходной ткани усаженный образец шёлка после обработки в дистиллированной воде был взят за эталон цвета. Результаты эксперимента приведены в Табл. 2. Вещества расположены в порядке убывания pH. Также мы проанализировали действие на шёлк четырех известных на рынке препаратов для аквачистки: PLEX® Lavaclean® Base, Büfa® Oldopal Basic, Büfa® Lizerna Carat, Kreussler® Lanadol® Aktiv.
Таблица №2. Эксперимент по воздействию различных веществ с pH>7, а также препаратов для аквачистки на натуральный шёлк при температуре раствора 25°С
* Условия эксперимента: раствор 100 мл в стакане 150 мл, якорь 40 мм, вращение 100 об/мин.
Результатом эксперимента, приближенного по условиям к аквачистке стал неоспоримый факт: усадка шёлка не зависит от щёлочности раствора и от типа соединения или препарата. При концентрации продуктов 1%, воды в растворе 99%, и она оказывает определяющее влияние на релаксацию волокон шёлка и последующую усадку. Таким образом, гораздо интереснее проанализировать разрушение материала и соответствующее изменение цвета.
Все четыре исследуемых препарата показали себя хорошо, и изменение цвета составило от 0,32 для PLEX® Lavaclean® Base до 0,51 для Kreussler® Lanadol® Aktiv несмотря на тот факт что pH первого средства составляет 8,13, а Oldopal Basic и Lizerna Carat – заметно меньше 7.
pH дистиллированной воды отличается от 7 в меньшую сторону (кислая среда) из-за растворения в ней углекислого газа при контакте с воздухом.
В случае гидроксида натрия и карбоната натрия наблюдается максимальный негативный эффект на материал и окраску (5,53 и 3,2 соответственно), то же самое справедливо и для гидрокарбоната натрия (1,82).
В случае аминов и комплексонов наблюдается крайне интересная картина: моноэтаноламин, диаэтаноламин и Трилон Б несмотря на относительно высокий уровень pH не оказывают негативного действия на материал. Даже учитывая то, что в воде происходит их диссоциация с образованием гидроксил-аниона (Рис. 8).
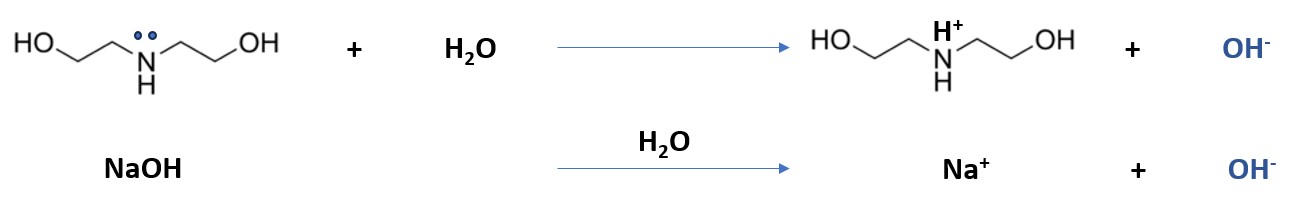
Рисунок 8. Диссоциация аминов и гидроксида натрия в воде с образование гидроксил-аниона.
Например, моноэтаноламин с pH равным 11,83 ед. ведет себя так же деликатно к шёлку, как и Büfa® Oldopal Basic с pH 5,65 ед. Трилон Б показал схожее деликатное действие, а GLDA-4Na напротив, вызвал разрушение.
Выводы:
- В водной среде натуральный шёлк подвержен усадке, не зависимо от используемых веществ и препаратов. Усадка составила около 10% по одному измерению.
- Потеря цвета и деструкция материала не наблюдается в случае специальных препаратов для аквачистки, органических аминов и Трилона Б. Объяснить это можно протекторным эффектом азот-содержащих соединений: в протонированной форме они с большой вероятностью подходят к отрицательно заряженным волокнам шёлка (в литературе этот эффект описан как трибоэлектрический) и препятствуют гидроксил-аниону воздействовать на белковые волокна. Подобный эффект можно наблюдать в случае ингибиторов коррозии металлов.
- Таким образом судить о негативном воздействии на белковые волокна тканей, располагая только значением pH средства, не зная состава и химической структуры компонентов нельзя!
Действие некоторых растворителей, а также усилителей для химической читки на натуральный шёлк в неводной среде
В предыдущем разделе было показано, что органические амины, которые являются стабилизаторами перхлорэтилена, даже в водной среде несут положительный протекторный эффект. Мы провели тестирование (Табл. 3) действия перхлорэтилена, растворителя SAFECHEM® SENSENE, комбинированного растворителя PLEX® GLYSOLVENT GU90, а также пяти усилителей компаний PLEX® и Kreussler® на натуральный шёлк.
Таблица №3. Эксперимент по воздействию различных препаратов для химической чистки на натуральный шёлк в среде перхлорэтилена, а также чистых растворителей PLEX® GLYSOLVENT GU90 и SAFECHEM® SENSENE
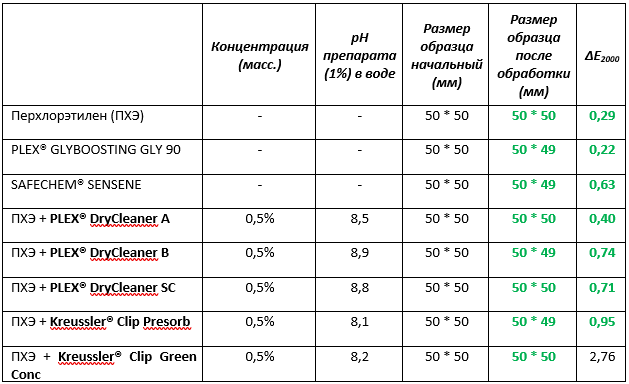
* Условия эксперимента: раствор 100 мл в стакане 150 мл, якорь 40 мм, вращение 100 об/мин, 25°С.
Во всех экспериментах усадка образцов не происходила или составляла не более 2%, что допустимо нормативами. Перхлорэтилен и PLEX® GLYBOOSTING GLY 90 показали наилучшие результаты, минимально воздействуя на цвет шёлка. Влияние растворителей SAFECHEM® SENSENE в пределах нормы менее 1 ед величины ΔE2000.
Добавление пяти усилителей химчистки PLEX® DryCleaner A, PLEX® DryCleaner B, PLEX® DryCleaner SC, Kreussler® Clip Presorb, Kreussler® Clip Green Conc в количестве 0,5% по массе в перхлорэтилене находятся в пределах нормы по изменению ΔE2000 и не заметно невооруженным глазом.
Выводы:
- Очередное подтверждение того, что неводная среда позволяет избежать усадки натурального шёлка.
- Химические усилители чистки повышают сход красителя с шёлка, но это не видно невооруженным глазом. Все известные исследуемые продукты на рынке соответствуют критериям безопасности и могут рекомендоваться к использованию.
- pH выше 7 ед., измеренный в водной среде, никак не коррелирует с каким-либо негативным воздействием на исследуемый материал.

Таким образом мы имеем четыре фактора для анализа негативного воздействия щелочной природы на материал:
- Среда: Неполярная или полярная.
- Длительность воздействия и температура.
- Концентрация гидроксид-аниона OH–. Значение pH.
- Механизм химического разрушения.
Автор выражает признательность к.х.н. Гольдберг Анне Евгеньевне за помощь в подготовке материала

